Avanços recentes permitem decifrar o DNA para prevenir, antecipar, tratar e até curar várias doenças. Saiba mais sobre os recursos que já estão disponíveis
Por Saúde é Vital
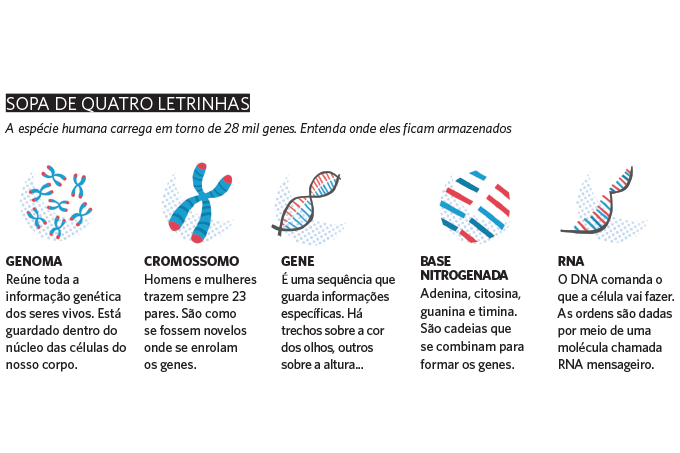
A de adenina, C de citosina, G de guanina e T de timina. Bastam essas quatro letrinhas para escrever o código da vida. Guardado no interior das células, o DNA tem uma simplicidade fascinante. Afinal, esses poucos ingredientes combinados determinam, em grande parte, quem somos e quais enfermidades temos agora ou desenvolveremos no futuro. Graças ao esforço e ao investimento de bilhões de dólares nas últimas décadas, a humanidade conseguiu entender um pouco melhor a genética e qual o significado desse emaranhado de informações para nossa saúde.
Um exemplo dessa conquista vem do nosso próprio país: cientistas da Universidade de São Paulo (USP) anunciaram o início do projeto “DNA do Brasil”. Com apoio da rede de laboratórios Dasa, da gigante de tecnologia Google, da empresa de insumos Illumina e do Ministério da Saúde, a meta é sequenciar o genoma completo de 15 mil brasileiros nos próximos dois anos.
“Atualmente, cerca de 80% das informações genéticas disponíveis são de europeus. Então não sabemos até que ponto alterações encontradas lá refletem o nosso povo, uma vez que também trazemos a mistura de populações indígenas e africanas”, justifica Lygia da Veiga Pereira, biofísica da USP e coordenadora da iniciativa.
Um trabalho realizado pela Dasa mostra como essas particularidades genéticas são relevantes. “Avaliamos os genes de 1 200 brasileiras com câncer de mama e encontramos seis mutações que nunca tinham sido descritas em outro lugar do mundo”, relata o patologista Gustavo Campana, diretor médico da companhia.
Será que essas variações não são uma janela de oportunidade para a criação de novas medicações? Ou remédios hoje encarados como uma segunda opção não seriam melhores para combater o tumor dessas pacientes? Só conhecendo a fundo o DNA da nossa gente encontraremos as respostas para essas e tantas outras perguntas.
E olha que esse não é o único esforço em âmbito nacional no campo da genética. O Hospital Israelita Albert Einstein, em São Paulo, fez uma parceria com o Ministério da Saúde e também vai vasculhar os genes de milhares de pessoas com doenças raras — enfermidades que atingem menos de 65 indivíduos a cada 100 mil habitantes.
“Além de obtermos dados muito interessantes, vamos estruturar um serviço de assistência para orientar e acompanhar esses pacientes, inclusive dentro do Sistema Único de Saúde”, detalha o geneticista João Bosco, diretor médico do laboratório Genomika, do Einstein.
As áreas da saúde em que o uso da genética já é realidade
Falar que a genética já faz parte do nosso dia a dia soa quase a exagero. Mas com uma pequena comparação histórica a gente percebe quanto esse domínio evoluiu e se popularizou: o Projeto Genoma Humano, finalizado em 2003, demorou 13 anos para ser concluído, custou 3 bilhões de dólares e necessitou de 240 mil equipamentos de 20 centros de pesquisa espalhados pelo mundo. Hoje é possível fazer essa mesma análise por mil dólares, em 24 horas e com apenas uma máquina. Tanta mudança em apenas 17 anos!
“O desenvolvimento da tecnologia do sequenciamento de nova geração que utilizamos trouxe velocidade e uma diminuição nos custos notáveis”, diz o cardiologista Alexandre Pereira da Costa, do Laboratório de Genética e Cardiologia Molecular do Instituto do Coração (InCor), em São Paulo.
Com o tempo, os cientistas foram percebendo que, na maioria dos casos, não valia a pena sequenciar a totalidade dos genes: é mais lógico vasculhar trechos específicos, com mutações e alterações relacionadas a determinadas doenças. Foi assim que surgiu uma série de exames disponíveis em diversos laboratórios para as mais diferentes especialidades médicas, muitos deles inclusive pagos pelos planos de saúde e até disponíveis na rede pública.
Um relatório global sobre o mercado de testes genéticos aponta que esse setor, atualmente com 133 grandes empresas, vai dobrar de tamanho até 2025.
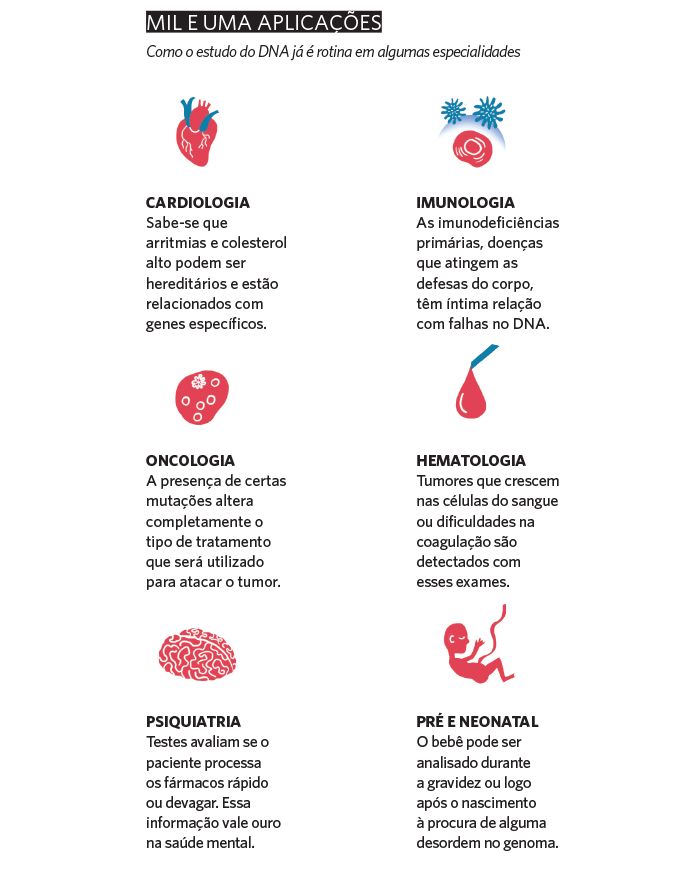
Uma das áreas que mais se beneficiaram de todos esses avanços foi a oncologia. Para muitos tipos de tumor, atualmente já é obrigatório fazer uma biópsia para saber quais falhas genéticas aparecem. Essas informações classificam a gravidade da doença e permitem selecionar o melhor tratamento para cada situação.
“No caso do câncer de ovário com certas mutações, foram criadas drogas que aumentam a sobrevida das pacientes em três anos”, ilustra a geneticista Maria Isabel Achatz, do Hospital Sírio-Libanês, em São Paulo.
Ainda nessa seara, as novas ferramentas permitem acompanhar famílias com maior propensão a alguns tumores e até agir preventivamente para evitar que algo aconteça — foi o que ocorreu com a atriz americana Angelina Jolie, que decidiu retirar as mamas e os ovários após descobrir um defeito no gene BRCA que poderia trazer uma encrenca das grandes no futuro.
A medicina reprodutiva também passou por uma verdadeira revolução na última década. “Antes de realizarmos a fertilização in vitro, temos a possibilidade de analisar os embriões para não implantar aqueles que apresentam algum problema”, explica o geneticista Ciro Martinhago, diretor da Chromosome Medicina Genômica, em São Paulo.
Essa estratégia pode ser uma boa para aquelas famílias com casos de enfermidades incapacitantes que passam de geração para geração.
Fuja das ciladas
É claro que no meio de tanta novidade há sempre pegadinhas e enganações. Algumas empresas oferecem testes para sugerir a melhor dieta ou o tipo de exercício mais benéfico para você. Outras companhias ofertam exames que indicam de onde seus ancestrais vieram e ainda apontam seu risco de sofrer com a doença X ou Y.
E mais: todo o processo é feito na própria casa do consumidor, sem a necessidade de um pedido médico. “Precisamos ver isso com cautela, pois muitas dessas informações não são 100% confiáveis com o nível de conhecimento que temos hoje”, alerta o geneticista Wagner Baratela, diretor do Fleury Medicina e Saúde.
Para interpretar os resultados e entender a aplicação prática deles, é essencial contar com o serviço de aconselhamento genético, feito por um profissional habilitado. “O especialista faz a avaliação antes e depois do exame e ajuda a entender aquele laudo, além de indicar os próximos passos para o paciente e sua família”, esclarece o geneticista David Schlesinger, CEO da Mendelics, na capital paulista.
A revolução da terapia gênica
A atrofia muscular espinhal (AME) é uma doença extremamente complicada. Os indivíduos acometidos apresentam uma falha no gene SMN1. Com isso, o corpo deles não fabrica uma proteína essencial para os neurônios motores, células responsáveis pela movimentação de todos os músculos.
O bebê não consegue se manter sentado, engatinhar ou dar os primeiros passos. O quadro, que é raro, evolui até o ponto em que não é possível nem respirar sem a ajuda de aparelhos. Infelizmente, a expectativa de vida desses indivíduos não ultrapassa os dez anos.
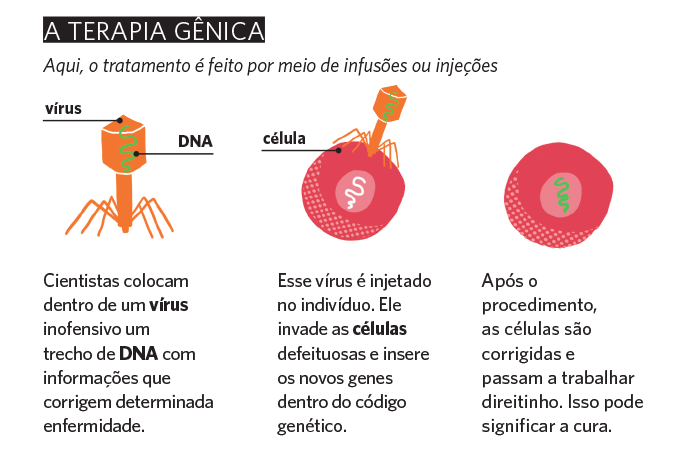
Agora, imagine se fosse possível corrigir essa mutação genética. A vida dos pacientes e seus familiares seria completamente diferente, não? Pois saiba que esse sonho se tornou realidade recentemente com a chegada da primeira terapia gênica.
Já liberada nos Estados Unidos e em análise para aprovação no Brasil, ela utiliza um vírus para inserir dentro do genoma um trecho de DNA que altera o gene SMN1 — assim ele passa a funcionar como o esperado. “Vale reforçar que esse vírus não tem capacidade de replicação nem provoca qualquer tipo de infecção”, explica a médica Janaína Lana, diretora da Novartis, farmacêutica responsável pela inovação.
E esse não é o único exemplo prático que temos no campo da terapia gênica. Outra formulação já disponível em terras americanas é capaz de corrigir um tipo raro de degeneração da retina, tecido no fundo do olho que capta o estímulo luminoso e o transmite ao cérebro para enxergarmos. Utilizando o mesmo princípio aplicado na AME, uma única injeção mexe com os genes e reverte a cegueira de forma definitiva. Parece coisa do futuro, mas já está no dia a dia de algumas pessoas.
Essas novidades apresentam enormes desafios, principalmente na questão financeira: só a terapia gênica para a AME custa nada menos que 2,1 milhões de dólares — algo em torno de 8,8 milhões de reais. Trata-se do medicamento mais caro da história. Quem tem condições de pagar? Será que os planos de saúde vão cobrir? Vai sobrar para o governo essa despesa?
“Ter tratamento é fantástico, mas o preço cobrado chega a ser cruel. Precisamos pensar nessa conta”, chama a atenção a geneticista Mayana Zatz, diretora do Centro de Pesquisas sobre o Genoma Humano e Células-Tronco da USP.
Enquanto esse dilema não se resolve, nos resta esperar para que o avançar das discussões e a própria competição de mercado derrubem os preços. Afinal, falamos de uma área com enorme investimento e com muitos interessados. Diversas farmacêuticas desenvolvem atualmente soluções para outras desordens de fundo genético.
O site Clinical Trials, mantido pelo governo dos Estados Unidos, calcula 1 754 estudos acontecendo neste momento com novas terapias gênicas. E essas pesquisas são feitas tanto por empresas gigantes, como Novartis, Roche e Pfizer, quanto por startups relativamente desconhecidas, como Spark Therapeutics e SQZ Biotechnologies. É provável que, em breve, tenhamos boas-novas contra betatalassemia, hemofilia, anemia falciforme…
Munição contra o câncer
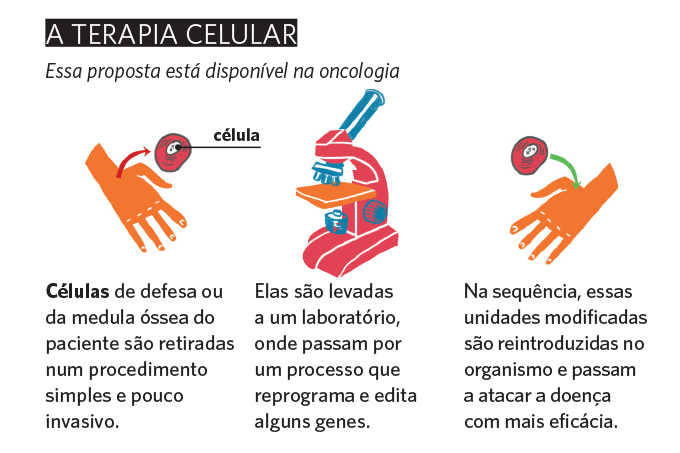
Outra vertente empolgante que usa os conhecimentos em genética para atacar as doenças é a terapia celular. O princípio é retirar células do organismo e modificar o genoma delas em laboratório para que passem a atuar contra algum defeito do organismo.
“Na oncologia, as chamadas CAR-T Cells já são comercializadas em alguns países como uma opção contra leucemia linfoide aguda e linfomas, dois tipos de câncer”, exemplifica o hematologista Nelson Hamerschlak, do Hospital Israelita Albert Einstein.
Esses tratamentos, também lançados pela Novartis, já receberam o sinal verde das agências regulatórias americanas e europeias há dois anos. “Estamos iniciando agora um estudo clínico no Brasil para obter resultados com a nossa população antes da aprovação por aqui”, conta o médico Douglas Vivona, gerente da companhia.
As limitações e questões éticas da genética
Como você pode perceber, as soluções para doenças raras estão avançando a passos largos. Um dos motivos para o sucesso recente é o fato de muitos desses quadros serem provocados por uma única mutação genética, o que facilita a identificação do problema e a busca por saídas.
Mas o que dizer das condições poligênicas, que estão relacionadas a várias falhas no DNA? É o caso de situações bem mais comuns, como obesidade, diabetes e hipertensão: elas ocorrem em função de diversas variações genéticas e, principalmente, por sua relação com comportamentos, hábitos e o ambiente. Será que algum dia teremos uma injeção poderosa que corrige o genoma com essa profundidade e extensão toda?
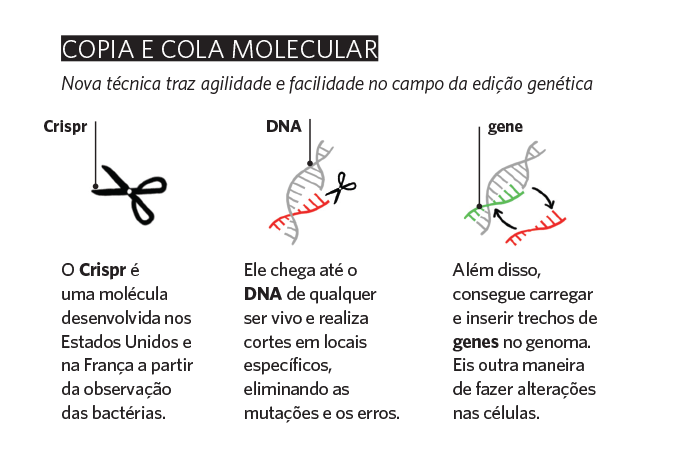
O consenso entre os especialistas é que, por ora, essa possibilidade não passa de ficção. Precisamos de décadas de pesquisa antes de ver esse tipo de terapia virar notícia. Mas o caminho pode ser encurtado graças à invenção do Crispr-Cas9, uma técnica de edição genética que está causando um verdadeiro rebuliço na comunidade científica internacional.
Escolhida como o maior avanço científico de 2015 pela prestigiada revista acadêmica Science, nos últimos cinco anos a técnica se tornou tema de debates acalorados e ganhou até as páginas policiais dos noticiários mundo afora.
O ponto principal de toda a história: falamos de um método relativamente simples e barato. Com ele, dá pra cortar e remendar o DNA de qualquer ser vivo, inserir novos genes numa sequência e fazer edições com mais facilidade. Atualmente, os especialistas carecem de muito conhecimento e maquinário caríssimo para obter resultados com as terapias gênicas e celulares já aprovadas por aí.
“Com o Crispr, é possível fazer experimentos com poucas exigências de laboratório e equipamentos bem menos sofisticados”, compara o geneticista Roberto Giugliani, professor do Departamento de Genética da Universidade Federal do Rio Grande do Sul.
Essa maior acessibilidade tem seus prós e contras. Por um lado, permite saltos inimagináveis nas pesquisas e aplicações médicas. Por outro, torna muito mais fácil ultrapassar barreiras éticas e cair em temas perigosos e delicados, como a eugenia.
Ninguém duvida que corrigir mutações genéticas que provocam doenças é importante. Mas o que dizer da possibilidade de escolher a cor dos olhos e do cabelo de um bebê? Será que deveríamos ter esse tipo de decisão em nossas mãos? Eis um dilema que todas as sociedades precisarão enfrentar muito em breve.
A história do cientista chinês He Jiankui demonstra a urgência da discussão. Em 2018, ele anunciou com orgulho que havia utilizado o Crispr para editar embriões humanos e torná-los resistentes ao HIV, o vírus causador da aids. Não satisfeito, o biofísico implantou as células em mulheres, que tiveram os bebês normalmente.
A notícia provocou espanto mundial: ainda nem entendemos como esse tipo de alteração genética funciona em plantas, que dirá em humanos! Há suspeitas de que as crianças editadas tenham efeitos colaterais desconhecidos no cérebro. No final de 2019, Jiankui foi condenado a três anos de prisão por suas ações ilegais.
Apesar da resposta das autoridades, o temor está no uso do Crispr por baixo dos panos, sem o acompanhamento de comitês de ética — sim, já existem biohackers atuando no submundo da ciência. Isso fez até com que a bióloga americana Jennifer Doudna, uma das criadoras da técnica, abandonasse o laboratório para investir seu tempo conscientizando os outros sobre o uso da tecnologia.
“Sonhei que recebia um convite para me reunir com um admirador do meu trabalho. Essa pessoa era Adolf Hitler. Fiquei horrorizada”, relatou a cientista durante uma conferência com jornalistas nos Estados Unidos em 2017.
Não tem volta: o maravilhoso mundo da genética chegou para ficar. Resta saber como usar essas ferramentas para resolver os grandes obstáculos da humanidade — sem criar novos problemas.
Ilustrações: Daniel Almeida/SAÚDE é Vital